PROTEÓMICA
OBJETIVO
GENERAL
- La proteómica proporciona un conjunto de herramientas muy poderosas para el estudio a gran escala de la función de los genes a nivel de una proteína.
OBJETIVOS ESPECÍFICOS
- Entender la importancia de la proteómica en el campo de la salud.
- Descripción de las bases para la búsqueda de biomarcadores y su aplicación en la proteómica médica.
- Establecer una conexión entre las secuencias biológicas y su comportamiento biológico.
INTRODUCCIÓN
Una vez concluida la secuenciación del genoma humano, es necesario disponer de técnicas que permitan comprender la relación entre la expresión de los genes y los problemas biológicos. Este es precisamente el campo de la proteómica, ciencia dedicada al estudio de la expresión de las proteínas y de sus cambios en dependencia del contexto biológico. A diferencia de las técnicas clásicas utilizadas en la bioquímica, la proteómica se basa en la separación y la identificación de muchas proteínas en el orden de mil o más simultáneamente.
Muchos de los métodos utilizados en proteómica permiten obtener un despliegue, ordenamiento o arreglo físico de mezclas muy complejas de proteínas, separadas mediante la combinación hábil de dos o más técnicas de separación. El término de proteómica fue acuñado en el año de 1997 como una analogía con la genómica, que es el estudio de los genes, los orígenes de la palabra proteoma son la fusión de proteína y genoma establecida en 1994 por Marc Wilkins mientras trabajaba en ese concepto como estudiante de doctorado.
3. ¿QUÉ ES LA PROTEÓMICA?
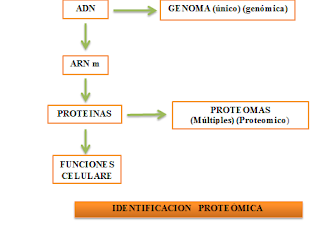
La Proteómica es el estudio del proteoma, el conjunto de proteínas expresadas en una célula determinada, en un tiempo y condiciones específicas. Para poder entender totalmente la proteómica, uno debe entender primero lo que son las proteínas. Una proteína es una macromolécula que consiste en una larga cadena de aminoácidos. Ésta cadena aminoacídica se construye (traduce) de acuerdo a la secuencia del ARN que ha sido transcrita del ADN . Ésta progresión desde ADN a ARN y luego de ARN a proteína se conoce comúnmente como el dogma central en Biología Molecular.
2. ESTRUCTURAS DE LAS PROTEÍNAS
Las proteínas se difieren en cuatro estructuras fundamentales las cuales son:
 |
Como consecuencia del establecimiento de enlaces peptídicos entre los distintos AA que forman la proteína se origina una cadena principal o "esqueleto" a partir del cual emergen las cadenas laterales de los aminoácidos.
La estructura secundaria de una proteína es la que adopta espacialmente. Existen ciertas estructuras repetitivas encontradas en las proteínas que permiten clasificarlas en dos tipos: hélice alfa y lámina beta.
Una hélice alfa es una apretada hélice formada por una cadena polipeptídica. La cadena polipetídica principal forma la estructura central, y las cadenas laterales se extienden por fuera de la hélice. El grupo carboxílo (CO) de un aminoácido n se une por puente hidrógeno al grupo amino (NH) de otro aminoácido que está tres residuos mas allá ( n + 4 ). De esta manera cada grupo CO y NH de la estructura central (columna vertebral o "backbone") se encuentra unido por puente hidrógeno.
Existen tres modelos de alfa hélice. El primero muestra solo al carbono alfa de cada aminoácido. El segundo muestra todos los átomos que forman la columna vertebral del polipéptido .
Las hélices generalmente están formadas por aminoácidos hidrófobos, en razón que son, generalmente, la máxima atracción posible entre dichos aminoácidos. Las hélices se observan, en variada extensión, prácticamente en todas las proteínas.
3. ESTRUCTURA TERCIARIA
 |
| PROTEÍNAS PLEGADAS |
La estructura terciaria es la estructura plegada y completa en tres dimensiones de la cadena polipeptídica, la hexoquinasa que se usa como icono en esta página es una estructura tridimensional completa a diferencia de la estructura secundaria, la estructura terciaria de la mayor parte de las proteínas es específica de cada molécula, además, determina su función.
El plegamiento terciario no es inmediato, primero se agrupan conjuntos de estructuras denominadas dominios que luego se articulan para formar la estructura terciaria definitiva. Este plegamiento está facilitado por uniones denominadas puentes di-sulfuro -S-S- que se establecen entre los átomos de azufre del aminoácido cisteína.
Existen dos tipos de estructuras terciarias básicas:
• proteínas fibrosas: Insolubles en agua, como la alfa queratina o el colágeno.
• proteínas globulares: Solubles en agua.
4.ESTRUCTURA CUATERNARIA
Solo está presente si hay mas de una cadena polipeptídica. Con varias cadenas polipeptídicas, la estructura cuaternaria representa su interconexión y organización.
Esta es la imagen de la hemoglobina, una proteína con cuatro polipéptidos, dos alfa-globinas y dos beta globinas. En rojo se representa al grupo hem complejo pegado a la proteína que contiene hierro, y sirve para transportar oxígeno.
La Proteómica permite identificar, categorizar y clasificar las proteínas con respecto a su función y a las interacciones que establecen entre ellas. De este modo, se pueden caracterizar las redes funcionales que establecen las proteínas y su dinámica durante procesos fisiológicos y patológicos. La proteómica se está aplicando en la identificación de nuevos marcadores para el diagnóstico de enfermedades, la identificación de nuevos fármacos, la determinación proteínas involucradas en al patogenia de enfermedades y el análisis de procesos de transducción de señales.
El proteoma de una célula varía según el estado en el que se encuentre la célula, si se encuentra en una situación de estrés, bajo el efecto de fármacos o de una hormona. Así, en cada momento y en cada tipo celular el perfil de proteínas expresadas será diferente. La proteómica es útil para estudiar estas diferencias. Existen tres ramas en la proteómica que tratan de caracterizar el proteoma estudiando distintos aspectos del mismo:
La Proteómica permite identificar, categorizar y clasificar las proteínas con respecto a su función y a las interacciones que establecen entre ellas. De este modo, se pueden caracterizar las redes funcionales que establecen las proteínas y su dinámica durante procesos fisiológicos y patológicos. La proteómica se está aplicando en la identificación de nuevos marcadores para el diagnóstico de enfermedades, la identificación de nuevos fármacos, la determinación proteínas involucradas en al patogenia de enfermedades y el análisis de procesos de transducción de señales.
El proteoma de una célula varía según el estado en el que se encuentre la célula, si se encuentra en una situación de estrés, bajo el efecto de fármacos o de una hormona. Así, en cada momento y en cada tipo celular el perfil de proteínas expresadas será diferente. La proteómica es útil para estudiar estas diferencias. Existen tres ramas en la proteómica que tratan de caracterizar el proteoma estudiando distintos aspectos del mismo:
4. RAMAS QUE CONSTITUYEN LA PROTEÓMICA
• LA PROTEÓMICA DE EXPRESIÓN: Se encarga del estudio de la abundancia relativa de las proteínas y de sus modificaciones postranscripcionales.
• LA PROTEÓMICA ESTRUCTURAL: consiste en la identificación de las proteínas que se expresan en una muestra biológica dada.
• LA PROTEÓMICA FUNCIONAL: Se encarga de la localización y distribución subcelular de proteínas y de las interacciones que se producen entre las proteínas y otras moléculas con el fin de determinar su función.
ÁREAS DE ESTUDIO DE LA PROTEÓMICA
Las principales áreas de estudio de la proteómica son:
• Identificación de proteínas y caracterización de sus modificaciones postraducionales.
• Proteómica de "expresión diferencial".
• Estudio de las interacciones proteína-proteína.
Su empleo para el análisis de mezclas complejas de proteínas ha sido posible gracias a dos avances importantes: la disponibilidad de bases de datos de secuencias de genes y de proteínas, y al desarrollo de métodos de ionización de péptidos. Proteómica de expresión: trata de medir diferencias en el contenido proteico (proteoma) celular entre dos situaciones distintas, por ejemplo, entre un tejido enfermo y uno sano. En un primer paso se separan “todas” las proteínas de un extracto complejo y luego se identifican las proteínas individuales, normalmente por su “huella peptídica” o por MS en tándem sobre péptidos fragmentados.
5. APLICACIONES DE LA PROTEÓMICA
Desde un punto de vista práctico son muchas las aplicaciones que se pueden vislumbrar en diversos terrenos científicos y biotecnológicos. Pero la aplicación más llamativa, con más impacto comercial, es el descubrimiento de fármacos, el diagnóstico molecular y la medicina personalizada. Este aspecto de la Proteómica está haciendo que la industria farmacéutica invierta grandes cantidades en el desarrollo de esta metodología y se esté avanzando rápidamente.
Los biomarcadores son biomoléculas que se determinan en un tejido o en un fluido corporal de un enfermo para definir una enfermedad a nivel molecular y para seguir o para predecir (prognosis) la respuesta a una terapia para una enfermedad determinada. Los marcadores proteicos ideales para la rutina clínica son los que se pueden detectar en el suero, ya que el suero contiene una información sobre el proteoma, que potencialmente refleja lo que está ocurriendo en cada tejido del cuerpo
Las proteínas expresadas por un organismo varían a lo largo de su desarrollo, de su crecimiento, en respuesta a estreses bióticos o abióticos, etc. En los organismos pluricelulares existe una variación adicional dentro del propio organismo que depende del tipo de tejido o células. La función de las proteínas que se expresan en un organismo está sometida además a modificaciones postraduccionales consistentes en la adición de residuos de azucares o lípidos.
La combinación de todos estos factores es lo que determina el proteoma funcional de un organismo, tejido o grupos de células en unas condiciones dadas. Un organismo tiene por tanto un gran número de proteomas. La determinación ideal de un proteoma, consistiría en la identificación, cuantificación y determinación de las modificaciones de todas las proteínas que se expresen en un organismo, tejido.
6. INDENTIFICACIÓN DE LA PROTEÓMICA
1. IDENTIFICACIÓN DE UN PROTEOMA: Separación de las proteínas presentes en la muestra que se quiere analizar: la técnica más utilizada por su fiabilidad y eficiencia es la electroforesis bidimensional en geles de poliacrilamida-SDS (2D PAGE).
2. IDENTIFICACIÓN DE LAS PROTEÍNAS: Las proteínas separadas, se digieren con una enzima hidrolítica (normalmente tripsina) dando lugar a un conjunto de péptidos específicos para cada proteína. La masa de estos péptidos se identifica mediante espectrometría de masas o secuenciación de sus extremos amino. La comparación de los datos obtenidos con las bases de datos apropiadas permite la identificación de la proteína analizada.
Notables progresos han sido realizados con la utilización de esta metodología, en campos como son la epidemiología, la taxonomía de patógenos microbianos y bacterias de interés agrícola, además en la identificación de nuevos mecanismos de patogenicidad y en el análisis de la resistencia bacteriana a los antibióticos. En cada una de estas áreas, el proteoma a provisto de nueva información que complementa las investigaciones basadas en los genomas bacterianos.
Este capítulo describe los progresos más recientes en el campo de la investigación realizada con proteomas además de algunos de los más importantes retos técnicos existentes para la aplicación de esta técnica en la microbiología.
Este capítulo describe los progresos más recientes en el campo de la investigación realizada con proteomas además de algunos de los más importantes retos técnicos existentes para la aplicación de esta técnica en la microbiología.
7. VENTAJAS CENTRALES DE LA PROTEÓMICA
•Investigadores trabajan a nivel de productos génicos, que son realmente expresos y llevan a un producto real, no solo siendo expreso y teniendo mRNA.
Limitaciones centrales de la proteómica:
• Generalmente, solamente una fracción de proteínas sintetizadas pueden ser detectadas en un experimento, sin embargo la expresión de todos los genes pueden ser monitora dos en un experimento de array.
•Buena resolución para proteínas
•Detección de modificaciones pósttranscripcionales
• No funciona bien para proteínas altamente hidrofóbicas
•Limitado por el rango de pH
•Difícil detección de proteínas poco abundantes
¿QUE TIPO DE INFORMACIÓN GENERA ?
•Información estructural
•Fragmentario de la muestra – análisis de productos
•Identificación de compuestos individuales en mezclas
complejas.
8. PROTEÓMICA Y SUS APLICACIONES EN LA SALUD HUMANA
Nuevas técnicas crean e incorporan avances en el diagnóstico, pronóstico, tratamiento y prevención de las enfermedades, permitiendo el advenimiento de nuevas estrategias terapéuticas.
1. Nuevos marcadores de diagnóstico en accidentes cerebrovasculares (ACV):
El accidente cerebro-vascular (ACV) ocurre por el bloqueo o ruptura del contenido del recipiente vascular sanguíneo del cerebro produciendo isquemia y hemorragia. Un 80% de los ACV son de tipo isquémico. Cuando el ACV está diagnosticado, el clínico necesita conocer la naturaleza del mismo a los efectos de la prescripción del tratamiento más adecuado. Por lo tanto, es muy importante tomar conocimiento de los biomarcadores. Muchos investigadores tienden a seguir un protocolo según las pautas de NIH (National Institute of Health), con un scanner CT e imagen de resonancia magnética nuclear. Luego, el examen excluye otras alteraciones como búsqueda de meningitis, cáncer, migraña, infecciones virales o desórdenes metabólicos.
2. Biomarcadores:
Se han estudiado bien tres que se encuentran asociados con neurotoxicidad que pueden ser determinados y medidos en la sangre: glutamato, homocisteina y también el N-metil aspartato y el receptor del autoanticuerpo (a Ab). Estos marcadores pueden dar una idea del grado de toxicidad de la isquemia cerebral
.
.
Empleando tecnología de MALDITOF fue posible encontrar en líquido céfalo raquídeo cinco picos pertenecientes a péptidos, en pacientes con Alzheimer.
A través de la proteómica se ha estudiado la expresión de diferentes proteínas asociadas a pacientes con accidentes cerebro-vasculares; 1) permite decidir estrategias de perfusión; 2) descubrir proteínas directa o indirectamente vinculadas con la enfermedad; 3) el conocimiento de las proteínas permite una clasificación precisa del ACV para una terapéutica más eficaz.
3. La Bioinformática - Herramienta vital:
La gran difusión internacional de la 2D Gel electroforesis ha sido posible gracias al desarrollo de la bioinformática.
El mapa del genoma humano ha suministrado un gran volumen de datos que representa la concreción de muchos años de trabajo y que forma la base del futuro proyecto de identificación de los genes humanos permitiendo conocer y estudiar la diversidad genética para determinar el estado de salud y la enfermedad.
9. BIBLIOGRAFIA
http://www.rac.es/ficheros/doc/00369.pdf
http://tesis.uson.mx/digital/tesis/docs/21788/Antecedentes.pdf
https://nutricionpersonalizada.wordpress.com/tag/proteomica/
http://www.scielosp.org/scielo.php?script=sci_arttext&pid=S0036-36342009000900004
ANEXOS: VÍDEOS RELACIONADOS CON EL TEMA DE PROTEÓMICA
PROCESO DE LA PROTEÓMICA ( ANALISIS)
ESTUDIO DE LAS PROTEÍNAS